MISSIONE
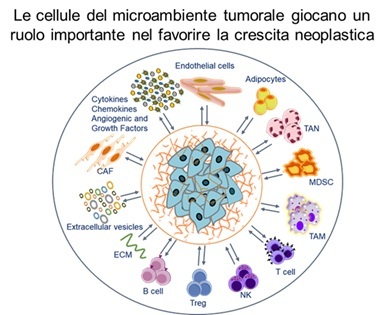
I tumori solidi sono da considerarsi ecosistemi in cui le diverse popolazioni cellulari ed i fattori solubili che compongono il microambiente tumorale (TME) stabiliscono relazioni complesse con le cellule neoplastiche governandone la crescita e tutte quelle funzioni che evolvono nell’acquisizione di un fenotipo invasivo/metastatico. Analogamente, nei tumori ematologici, le cellule tumorali interagiscono con il microambiente ematopoietico e le cellule immuni, dove si verificano processi simili di immunosoppressione e modulazione della risposta immune. Il TME è infatti costituito dalle cellule tumorali stesse, e da cellule stromali normali e trasformate, cellule endoteliali e cellule immunitarie, vescicole extracellulari, proteine della matrice extracellulare, nonché componenti solubili quali le citochine, chemochine, fattori di crescita e pro-angiogenici. L’attività di ricerca del Laboratorio Modelli Preclinici di Progressione Tumorale è incentrata sullo studio dei meccanismi molecolari che regolano il “cross talk” delle cellule tumorali con la matrice extracellulare e con le cellule immuni che compongono il TME allo scopo di ottenere informazioni utili al chiarimento dei processi che intervengono nelle diverse fasi della progressione tumorale e sperimentare fino ad uno stadio preclinico inibitori della: i) invasione e metastatizzazione delle cellule neoplastiche, ii) neoangiogenesi iii) attività immunosoppressiva delle cellule immuni del TME.
MISSION
Solid tumors are ecosystems in which different cell populations that compose the tumor microenvironment (TME) establish complex relationships with neoplastic cells, governing their growth and all those functions that evolve in the acquisition of an invasive/metastatic phenotype. In addition to tumor cells, TME contains extracellular matrix proteins, normal and transformed stromal cells, endothelial and immune cells, vesicles of different sizes released by tumor cells, as well as soluble components that include cytokines, chemokines, as well as growth and proangiogenic factors. The mission of this Laboratory is devoted to investigate the molecular mechanisms that regulate the “crosstalk” between tumor cells and cellular and soluble components of TME in order to identify that processes that govern the different phases of tumor progression. Results will allow us to identify and experiment up to a preclinical stage the capability of therapeutic agents to counteract the metastatic diffusion of cancer cells, such as inhibitors of tumor cell proliferation, migration and matrix invasion of tumor cells, as well as new drugs preventing neoangiogenesis and/or immunosuppressive activity of TME.
RICERCA
I progetti più recenti hanno l’obiettivo di identificare nuovi target di significato prognostico nei tumori solidi ed ematologici, utili per lo sviluppo di nuove strategie terapeutiche con i seguenti end-point: i) identificare i checkpoint immunitari coinvolti nel blocco dell’immunità antitumorale; ii) definire il contributo delle cellule mieloidi, delle vescicole extracellulari e dei fattori solubili (chemochine, citochine, fattori di crescita e proangiogenici) nel sostenere la progressione tumorale; iii) rieducare un TME disfunzionale con farmaci tradizionali e/o di nuova generazione in grado di agire sui checkpoint immunitari coinvolti nel blocco dell’immunità antitumorale e neoangiogenesi.
RESEARCH
Our recent projects aim to identify new targets of prognostic significance in solid tumors, useful for development of new therapeutic strategies with the following end-points: i) dentify the immune checkpoints involved in blocking the antitumor immunity; ii) define the contribution of myeloid cells and soluble factors (chemokines, cytokines, growth and proangiogenic factors) in supporting tumor progression; iii) re-educate a dysfunctional TME with traditional and/or new generation drugs able to act on the immune checkpoints involved in blocking antitumor immunity and neoangiogenesis.

Progetto Ricerca ACC Reti RCR-2022-23682287 finanziato dal Ministero della Salute. Collaboratori: Dr. Maria Vincenza Carriero, Dr. Michele Minopoli e Dr.Vncenzo Ingangi.
ACC-Network Research Project RCR-2022-23682287 funded by the Ministry of Health. Collaborators: Dr. Maria Vincenza Carriero, Dr. Michele Minopoli and Dr. Ingangi.
Progetto Ricerca Corrente 2025-2027 – RITMES finanziato dal Ministero della Salute: Ri-educare il Microambiente Tumorale disfunzionale per un approccio terapeutico innovativo del sarcoma. Responsabile scientifico: Dr. Maria Vincenza Carriero.
Project 2025-2027 – RITMES funded by the Ministry of Health: Re-educating the Dysfunctional Tumor Microenvironment for an Innovative Therapeutic Approach to Sarcoma. PI: Dr. Maria Vincenza Carriero.
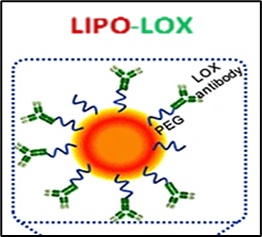
Progetto PNRR POC-2022-12376579 – TRUST finanziato dal Ministero della Salute: Engineered lisyl oxidase lipid-based nanovesicles for the treatment of solid tumors: on the path to clinical application. Responsabile scientifico dell’UO 4: Dr. Maria Vincenza Carriero.
Project PNRR – POC-2022-12376579 – TRUST funded by the Ministry of Health: Engineered lisyl oxidase lipid-based nanovesicles for the treatment of solid tumors: on the path to clinical application. PI lUO 4: Dr Maria Vincenza Carriero.
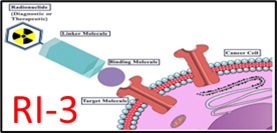
Progetto PNRR POC-2023-12377318 – RITAST finanziato dal Ministero della Salute: Inibitori radiomarcati di FPR1 per un’applicazione teranostica su tumori solidi. Responsabile scientifico: Dr. Maria Vincenza Carriero.
Project PNRR POC-2023-12377318- RITAST funded by the Ministry of Health: Radiolabeled FPR1 Inhibitors for a Theranostic Application on Solid Tumors. PI: Maria Vincenza Carriero.PI Dr. Maria Vincenza Carriero.
Progetto Ricerca Corrente 2025-2027 e CE EPOCA 2022-2025 finanziato dal Ministero della Salute: HSP90 ed mTOR veicolati dai Large Oncosomes come Responsabile scientifico: Dr.ssa Chiara Ciardiello.
Project 2025-2027 and CE EPOCA 2022-2025 funded by the Ministry of Health: HSP90 and mTOR delivered by Large Oncosomes ed mTOR veicolati dai Large Oncosomes. PI: Dr.ssa Chiara Ciardiello.
Progetto PNRR-TR1-2023-12377450 finanziato dal Ministero della Salute: Decoding the Extracellular vesicles driven communication in the microenvironment of Hairy cell Leukemia to improve patient care management. Responsabile Scientifico under 40 della UO2: Dr.ssa Chiara Ciardiello.
Project PNRR-TR1-2023-12377450 funded by Ministry of Healt: Decoding the Extracellular vesicles driven communication in the microenvironment of Hairy cell Leukemia to improve patient care management. PI under 40 of UO2: Dr.ssa Chiara Ciardiello.
PERSONALE E STAFF
Direttore/Lab Director Dr. Maria Vincenza Carriero tel. 081 17770581 email: m.carriero@istitutotumori.na.it Dirigenti Sanitari/Staff investigator (Biologist): Dr. Chiara Ciardiello tel. 081 17770623 Email: c.ciardiello@istitutotumori.na.it Ricercatori Sanitari/Health Researcher: Dr. Michele Minopoli tel. 081 17770623 Email: m.minopoli@istitutotumori.na.it Dr. Vincenzo Ingangi tel. 081 17770643 Email: vincenzo.ingangi@istitutotumori.na.it Coll. Profess. Supporto alla ricerca/Collaborating Researcher: Dr. Gioconda Di Carluccio tel. 081 17770579 Email: g.dicarluccio@istitutotumori.na.it
Ricercatori Sanitari a tempo determinato/Health Researcher: Dr. Maurizio Maddalena tel. 081 17770623 Email: maurizio.maddalena@istitutotumori.na.it Dr. Vincenzo Di Vaia tel. 081 17770623 Email: vincenzo.divaia@istitutotumori.na.it Borsisti/Fellows: Dr. Roberta Gatti tel. 081 17770643 Email: roberta.gatti@istitutotumori.na.it Dr. Sara Scala tel. 081 17770643 Email: sara.scala@istitutotumori.na.it
PRINCIPALI PUBBLICAZIONI/RELEVANT PUBLICATION
Dr. Maria Vincenza Carriero Produzione Scientifica Complessiva: Autore di N. 90 Pubblicazioni scientifiche su Riviste recensite, su argomenti di oncologia di base e traslazionale.
- ORCID ID: 0000-0002-9768-2997
- Scopus Author Id: 6701534447
- RESEARCH ID: K-1240-2018
- Official H Index: 35 (Scopus)
- Ingangi V, De Chiara A, Ferrara G, Gallo M, Catapano A, Fazioli F, Di Carluccio G, Peranzoni E, Marigo I, Carriero MV, Minopoli M. Emerging Targeted Therapeutic Strategies to Overcome Imatinib Resistance of Gastrointestinal Stromal Tumors. 2024 Jun 4;13(11):977. PMID: 38891109; PMCID: PMC11171855. doi: 10.3390/cells13110977.
- Castaldo V, Minopoli M, Di Modugno F, Sacconi A, Liguoro D, Frigerio R, Ortolano A, Di Martile M, Gesualdi L, Madonna G, Capone M, Cirombella R, Catizone A, Del Bufalo D, Vecchione A, Carriero MV, Ascierto PA, Mancini R, Fattore L, Ciliberto G. Upregulated expression of miR-4443 and miR-4488 in drug resistant melanomas promotes migratory and invasive phenotypes through downregulation of intermediate filament nestin. J Exp Clin Cancer Res. 2023 Nov 27;42(1):317. doi: 10.1186/s13046-023-02878-9.
- Cinti S, Tomassi S, Ciardiello C, Migliorino R, Pirozzi M, Leone A, Di Gennaro E, Campani V, De Rosa G, D’Amore VM, Di Maro S, Donati G, Singh S, Raucci A, Di Leva FS, Kessler H, Budillon A, Marinelli L. Paper-based electrochemical device for early detection of integrin αvβ6 expressing tumors. Commun Chem. 2024 Mar 21;7(1):60. doi: 10.1038/s42004-024-01144-z. PMID: 38514757; PMCID: PMC10957923.
- Minopoli M, Sarno S, Cannella L, Tafuto S, Scognamiglio G, Gallo M, Fazioli F, Azzaro R, Apice G, De Angelis B, Tamborini E, Garofalo C, Pignochino Y, Mercatali L, Ibrahim T, Falcioni R, Valenti B, Maestro R, Scotlandi K, De Chiara A, Carriero MV. Crosstalk between Macrophages and Myxoid Liposarcoma Cells Increases Spreading and Invasivenes of TumorCells. Cancers (Basel). 2021 Jun 30;13(13):3298. doi: 10.3390/cancers13133298.
- Racanelli D, Brenca M, Baldazzi D, Goeman F, Casini B, De Angelis B, Guercio M, Milano GM, Tamborini E, Busico A, Dagrada G, Garofalo C, Caruso C, Brunello A, Pignochino Y, Berrino E, Grignani G, Scotlandi K, Parra A, Hattinger CM, Ibrahim T, Mercatali L, De Vita A, Carriero MV, Pallocca M, Loria R, Covello R, Sbaraglia M, Dei Tos AP, Falcioni R, Maestro R. Next-Generation Sequencing Approaches for the Identification of Pathognomonic Fusion Transcripts in Sarcomas: The Experience of the Italian ACC Sarcoma Working Group. Front Oncol. 2020 Apr 15;10:489. doi: 10.3389/fonc.2020.00489.
- Minopoli M, Sarno S, Di Carluccio G, Azzaro R, Costantini S, Fazioli F, Gallo M, Apice G, Cannella L, Rea D, Stoppelli MP, Boraschi D, Budillon A, Scotlandi K, De Chiara A, Carriero MV. Inhibiting Monocyte Recruitment to Prevent the Pro-Tumoral Activity of Tumor-Associated Macrophages in Chondrosarcoma. Cells. 2020 Apr 24;9(4). doi: 10.3390/cells9041062.
- Ciardiello C, Leone A, Lanuti P, Roca MS, Moccia T, Minciacchi VR, Minopoli M, Gigantino V, De Cecio R, Rippa M, Petti L, Capone F, Vitagliano C, Milone MR, Pucci B, Lombardi R, Iannelli F, Di Gennaro E, Bruzzese F, Marchisio M, Carriero MV, Di Vizio D, Budillon A. Large oncosomes overexpressing integrin alpha-V promote prostate cancer adhesion and invasion via AKT activation. J Exp Clin Cancer Res. 2019 Jul 18;38(1):317. doi: 10.1186/s13046-019-1317-6. PMID: 31319863; PMCID: PMC6639931.
- Minopoli M, Botti G, Gigantino V, Ragone C, Sarno S, Motti ML, Scognamiglio G, Greggi S, Scaffa C, Roca MS, Stoppelli MP, Ciliberto G, Losito NS, Carriero MV.Targeting the Formyl Peptide Receptor type 1 to prevent the adhesion of ovarian cancer cells onto mesothelium and subsequent invasion. J Exp Clin Cancer Res. 2019 Nov 8;38(1):459. doi: 10.1186/s13046-019-1465-8.
- Minopoli M, Polo A, Ragone C, Ingangi V, Ciliberto G, Pessi A, Sarno S, Budillon A, Costantini S, Carriero MV.Structure-function relationship of an Urokinase Receptor-derived peptide which inhibits the Formyl Peptide Receptor type 1 activity. Sci Rep. 2019 Aug 21;9(1):12169. doi: 10.1038/s41598-019-47900-3.
- Ingangi V, Minopoli M, Ragone C, Motti ML, Carriero MV. Role of Microenvironment on the Fate of Disseminating Cancer Stem Cells. Front Oncol. 2019 Feb 21;9:82. doi: 10.3389/fonc.2019.00082.
CLINICAL TRIALS
RITMES – Ri-educare il Microambiente Tumorale disfunzionale per un approccio terapeutico innovativo del sarcoma. Studio osservazionale che ha come scopo finale quello di valutare potenziali biomarcatori nel sangue periferico e nel tessuto tumorale di pazienti affetti da condrosarcoma. [Protocollo CEI: 54/22 oss].
RITMES– Re-educating the Dysfunctional Tumor Microenvironment for an Innovative Therapeutic Approach to Sarcoma. Observational study with the final aim of evaluating potential biomarkers in peripheral blood and tumor tissue of patients affected by chondrosarcoma. [CEI Protocol: 54/22 obs]
BREVETTI/PATENTS
- 2020. Patent N. P3442989: Retro-inverso peptide inhibitors of cell migration, extracellular matrix and endothelial invasion by tumor cells. AUTORI: Carriero MV, Bifulco K, Ciliberto G, Pessi A.
- 2020. Patent N. US20190135863: Retro-inverso peptide inhibitors of cell migration, extracellular matrix and endothelial invasion by tumor cells. AUTORI: Carriero MV, Bifulco K, Ciliberto G, Pessi A.
- 2013. Patent N. US8354374: Peptides having pharmacological activity for treating disorders associated with cell migration, such as cancer. AUTORI: Carriero MV, Pavone V, De Rosa M.