MISSIONE/MISSION
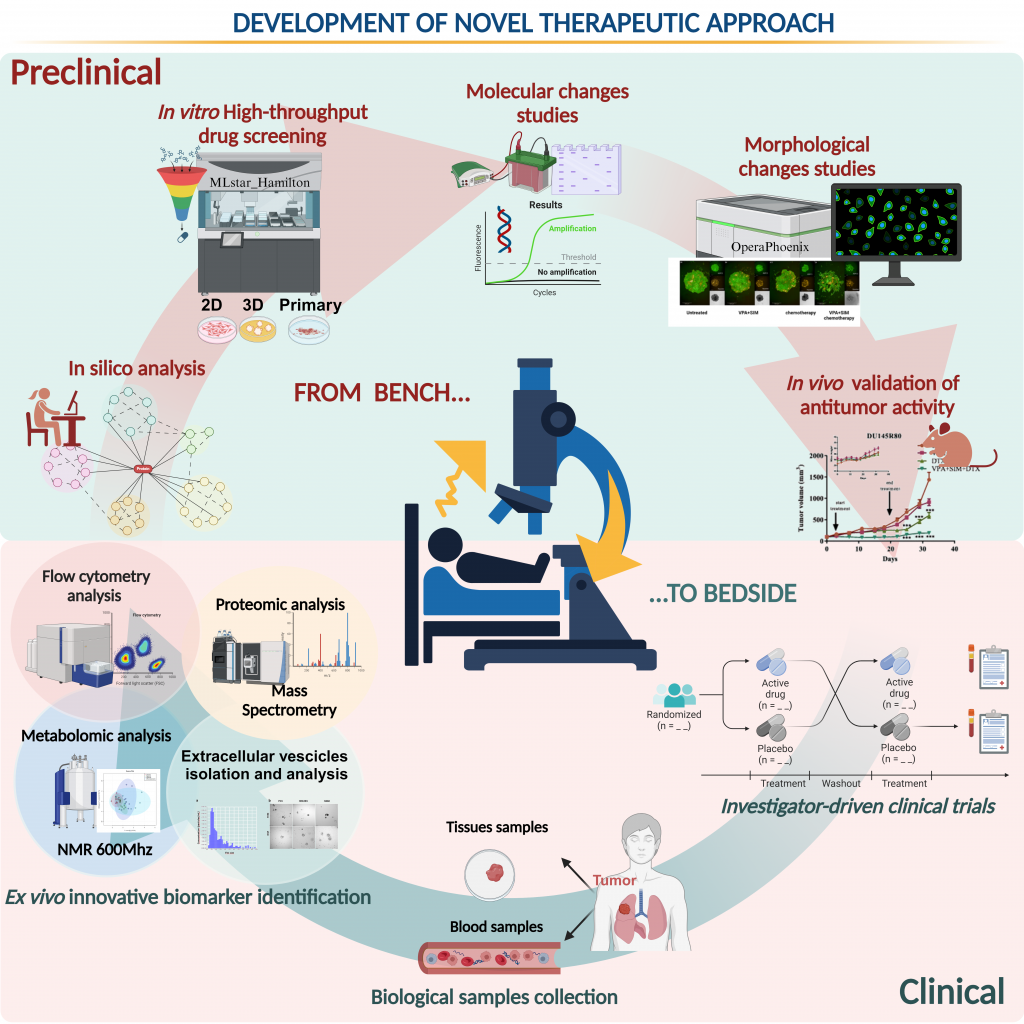
La missione della Struttura Complessa di Farmacologia Sperimentale Oncologica è principalmente lo sviluppo preclinico e clinico di nuovi approcci terapeutici antitumorali, con l’obiettivo di migliorare l’efficacia dei trattamenti, ridurne la tossicità e tradurli in tempi rapidi al letto del malato. Tale obiettivo si articola in diverse azioni principali: 1. Nuove combinazioni farmacologiche, utilizzando farmaci epigenetici e farmaci da riposizionare; 2. Utilizzo di modelli preclinici complessi (colture/co-colture tumore/TME in 3D; modelli immuno-competenti; PDX); 3. Utilizzo di high throughput e high-content screening; 4. Identificazione di nuovi marcatori prognostici e/o predittivi di risposta mediante citometria a flusso, analisi flussomica, metabolomica, lipidomica e proteomica, isolamento di vescicole extra-cellulari e systems biology; 5. Analisi “in silico” (modellamento molecolare e screening virtuale). | The mission of the Unity of Oncological Experimental Pharmacology is mainly the preclinical and clinical development of new anti-tumor therapeutic approaches, with the aim of improving the effectiveness of treatments, reducing their toxicity, and quickly translating them to the bedside of the patient. This objective is divided into several main actions: 1. New pharmacological combinations, using epigenetic drugs and repositioning drugs; 2. Use of complex preclinical models (3D tumor/TME cultures/co-cultures; immune-competent models; PDX); 3. Use of high throughput and high content screening; 4. Identification of new prognostic and/or predictive markers of response using flow cytometry, flowomics, metabolomics, lipidomics and proteomics, isolation of extra-cellular vesicles and systems biology; 5. “In silico” analysis (molecular modeling and virtual screening). |
RICERCA/RESEARCH
| L’attività di ricerca del laboratorio di Farmacologia Sperimentale Oncologica è mirata a raggiungere gli obiettivi della missione sviluppando progetti di ricerca, anche in collaborazione con altri gruppi di ricerca Italiani e Stranieri, basati su finanziamenti Nazionali ed Internazionali. Di seguito, alcuni dei progetti di ricerca attualmente in corso: REMEDI4ALL Il progetto REMEDI4ALL (BUILDING A SUSTAINABLE EUROPEAN INNOVATION PLATFORM TO ENHANCE THE REPURPOSING OF MEDICINES FOR ALL) (PI: Dott. Alfredo Budillon) [Bando HORIZON-HLTH-2021-DISEASE-04 (EU)] ha l’ambizione di creare una piattaforma europea di ricerca e innovazione, incentrata sui bisogni del paziente, che faciliti l’accesso, lo sviluppo rapido ed economico, a farmaci riposizionati. REMEDi4ALL è un consorzio multidisciplinare guidato da EATRIS, che coinvolge ventiquattro organizzazioni europee, di cui quattro italiane, con l’obiettivo comune di riposizionare farmaci già in uso clinico, per altre indicazioni terapeutiche. Il progetto, iniziato il 1 settembre 2022, ha durata di 5 anni in cui la piattaforma fornirà servizi in tutte le fasi di sviluppo necessarie al riposizionamento del farmaco, dal finanziamento allo sviluppo preclinico, dalla sperimentazione clinica all’immissione sul mercato. The VESPA trial Il progetto “Randomized phase-2 study of Valproic acid combinEd with Simvastatin and gemcitabine/nab-paclitaxel-based regimens in untreated metastatic Pancreatic Adenocarcinoma patients (The VESPA trial)” [RF-2021-12371995] (PI: Dott. Alfredo Budillon), finanziato dal Ministero della Salute nell’ambito del Bando di Ricerca Finalizzata 2021, è uno studio di fase 2 multicentrico progettato come uno studio incentrato sul paziente che mira a determinare se l’aggiunta di due farmaci da riposizionamento, l’acido valproico e la simvastatina, al trattamento standard con gemcitabina/nab-paclitaxel possa migliorare il tempo in cui la malattia non progredisce (sopravvivenza libera dalla progressione) in pazienti con carcinoma del pancreas (PDAC) metastatico. Lo studio coinvolgerà 240 pazienti provenienti da diversi centri in Italia e Spagna. Pharmacology targeting of CtBP1/BARS in cancer Il progetto “Pharmacology targeting of CtBP1/BARS in cancer” [GR-2018-12367517] (PI: Dott.ssa Alessandra Leone), finanziato dal Ministero della Salute nell’ambito del Bando di Ricerca Finalizzata 2018, mira all’identificazione di piccole molecole capaci di legare la proteina CtBP/BARS, essenziale per il traffico intracellulare di membrana e per la ripartizione del complesso di Golgi nelle cellule figlie prima della mitosi, ma che agisce anche come co-repressore della trascrizione. Obiettivo del progetto è testare l’attività antitumorale delle molecole identificate, sia in monoterapia che in associazione con la terapia convenzionale, in modelli di carcinoma prostatico. Inoltre, il progetto si propone di valutare anche il ruolo di BARS nella secrezione di fattori pro-tumorali del tumore della prostata ed, in particolare, nella regolazione della secrezione di Large Oncosomes (LO) e del loro contenuto. ACC_2022_MOD_PRECLINICI Il progetto “The ACC preclinical research platform for precision oncology ” [RCR-2022-23682287], finanziato dal Ministero della Salute nell’ambito del Bando di Ricerca corrente Reti IRCCS 2022, prevede lo sviluppo di modelli sperimentali che possano ricapitolare correttamente la biologia del tumore, l’eterogeneità genetica e la risposta ai farmaci. In questa direzione, la rete di Alleanza Contro il Cancro (ACC) ha incluso da anni nel suo programma di ricerca varie attività dedicate alla generazione di modelli di cancro derivato dal paziente (PDCM), alla loro profilazione molecolare e ai test farmacologici su questi modelli. Il presente progetto mira ad ampliare ulteriormente questa linea di ricerca, per generare una piattaforma preclinica che faciliti le attività dei membri di ACC. Gli obiettivi del progetto quindi sono: generare e rendere disponibile online un catalogo condiviso dei PDCM generati dai vari tipi di cancro; sviluppare PDCM innovativi, condividere protocolli e procedure standard per la generazione di PDCM; generare e condividere profili DNA-seq e RNA-seq dei PDCM, profilando ove disponibili anche il tessuto tumorale di origine e il DNA germinale; aumentare la capacità di screening farmacologici attraverso una rete di nodi tecnologici e facilitare la validazione preclinica delle ipotesi terapeutiche generate nella rete ACC mediante i profili molecolari eseguiti sui tumori dei pazienti. NARA Il progetto dal titolo “Multiparameter optimization and in vitro/in vivo assessment of antagonists targeting androgen receptor’s ligand binding domain and allosteric binding sites” (Short title: In vitro/in vivo tests of New Androgen Receptor Antagonists – NARA) rientra nei progetti di collaborazione tra Italia e Sud Africa – Progetti di Grande Rilevanza (PGR) inseriti nei Protocolli Esecutivi bilaterali scientifico-tecnologici, finanziato dal Ministero degli Affari Esteri e della Cooperazione Internazionale. E’ frutto di una collaborazione nata con il gruppo del Dr Gumede Njabulo dell’Università di Mangosuthu University of Technology (MUT) –Sud Africa. L’obiettivo del progetto è quello di sviluppare nuovi ed efficaci antagonisti del recettore degli androgeni per superare la resistenza alla castrazione e agli anti-androgeni di seconda generazione nel cancro alla prostata (PCa), basandosi sulla validazione preclinica, in vitro ed in vivo, di nuovi antagonisti dei recettori degli androgeni derivati da uno screening virtuale. canSERV Il progetto “Providing cutting edge cancer research services across Europe – canSERV”, finanziato dall’UE nell’ambito del programma Horizon Europe [Bando HORIZON-INFRA-2021-SERV-01 (Research infrastructure services to support health research, accelerate the green and digital transformation, and advance frontier knowledge (2021)], ha come obiettivo di offrire un portafoglio completo di servizi di ricerca legati all’oncologia a disposizione di tutti gli scienziati nei paesi membri dell’UE, nei paesi associati e oltre. La nostra struttura è coinvolta nella caratterizzazione e validazione di risultati in modelli tumorali in vitro (2D e 3D) nonché in esperimenti di proteomica. In collaborazione con la SSD di Sperimentazione Animale per la caratterizzazione e validazione in modelli murini. TACTIC Il progetto “Targeting drug resistant melanoma with miCroRNAs delivered by Lipid NanoparTICles (TACTIC)” [PNRR-POC-2022-12375713] (PI UO: Dott.ssa Susan Costantini), finanziato dal Ministero della Salute nell’ambito del Bando PNRR: M6/C2_CALL 2022 – Proof of Concept (PoC), si propone di eseguire studi per determinare la dose massima tollerata delle nanoparticelle lipidiche che veicolano tre miR oncosoppressori insieme simultaneamente (miR-204-5p, miR-579-3p e miR-199b-5p) (LNP-miR) da utilizzare negli studi di efficacia e dimostrare l’efficacia terapeutica di LNP-miR nel “revertire” la resistenza farmacologica in modelli murini. Il progetto si propone inoltre di generare PDX derivati da lesioni tumorali di pazienti resistenti ai farmaci al fine di validare in questi modelli i risultati ottenuti. MITOFRAILTY Il progetto “Mitochondrial genetic and functional analysis for a personalized frailty assessment in critically ill patients (MITOFRAILTY)” (PI UO: Dott.ssa Elena Di Gennaro) [Bando PNRR: M6/C2_CALL 2022], finanziato dal Ministero della Salute nell’ambito del Bando PNRR-MAD-2022-12376767] – Malattie Croniche non Trasmissibili (MCnT), si propone di identificare marcatori di fragilità per una selezione precoce dei pazienti a rischio elevato di permanenza prolungata in ospedale e di esiti avversi. Poiché il mal funzionamento dei mitocondri può essere considerato un biomarcatore della fragilità e un potenziale bersaglio per la prevenzione e la terapia, lo stress ossidativo, la respirazione mitocondriale e il numero di copie del mtDNA saranno misurati nelle cellule del sangue di pazienti ricoverati in terapia intensiva dell’Ospedale Universitario Sant’Andrea di Roma al fine di identificare marcatori specifici di fragilità. PNRR-MCNT2-2023-12377998 Il progetto “ValproIc aCid To pOtentiate anti-EGFR treatment efficacy and prevent/revert resistance In colorectal cAncer (VICTORIA)” (PNRR-MCNT2-2023-12377998) (PI: Dott. Alfredo Budillon) [Bando PNRR: M6/C2_CALL 2023 – Malattie croniche non trasmissibili (MCnT2) ad alto impatto sui sistemi sanitari e socioassistenziali: innovazione in campo terapeutico – Ministero della Salute] si propone di valutare, in studi preclinici e nell’ambito dello studio clinico VICTORIA in pazienti con tumori del colonretto metastatico (mCRC) in assenza di mutazioni dei geni RAS e BRAF, se l’aggiunta dell’acido valproico (VPA), dotato di proprietà epigenetiche, sia in grado di migliorare l’attività dei farmaci anti-EGFR, andando a prevenire e/o ritardare l’insorgenza della resistenza agli agenti anti-EGFR. Inoltre, studi traslazionali su campioni di tessuto e sangue, contribuiranno ad identificare potenziali biomarcatori di efficacia e a comprendere le dinamiche evolutive dei tumori in risposta alla terapia, al fine di comprendere i meccanismi di resistenza e ottimizzare l’approccio terapeutico con anticorpi monoclonali anti-EGFR. PNRR-MCNT2-2023-12377229 Il progetto “New theranostic biomarkers of Intraductal papilary mucinous neoplasm (IPMN) progression to pancreatic cancer for patients outcome improvement” (PNRR-MCNT2-2023-12377229) (PI UO: Dott.ssa Elena Di Gennaro) [Bando PNRR: M6/C2_CALL 2023 – Malattie croniche non trasmissibili (MCnT2) ad alto impatto sui sistemi sanitari e socioassistenziali: innovazione in campo terapeutico – Ministero della Salute] si propone di identificare marcatori molecolari in grado di prevedere la trasformazione maligna delle neoplasie mucinose papillari intraduttali (IPMN) ad adenocarcinoma duttale pancreatico (PDAC) per selezionare quei pazienti che necessitano di un intervento chirurgico immediato al pancreas. In dettaglio sarà effettuata una caratterizzazione epitelio-specifica delle IPMN da un punto di vista sia dell’espressione genica (singoli nuclei) che dei cambiamenti dell’epigenoma (ATAC-seq) in campioni di IPMN e di cancro pancreatico. In secondo luogo verranno validati i marcatori precedentemente identificati ed il loro ruolo come fattori prognostici sia su campioni di tessuto d’archivio sia su plasma, mediante un’analisi retrospettiva su una coorte di pazienti affetti da IPMN. Inoltre verranno sviluppati tools knowledge-based per la diagnosi e il trattamento dei pazienti affetti da IPMN e della popolazione a rischio di cancro pancreatico e verranno eseguite analisi di validazione per stabilire il ruolo specifico dei geni più rilevanti nella carcinogenesi dell’IPMN, attraverso un’inibizione farmacologica (laddove possibile) o un approccio genetico utilizzando la metodologia di editing genomico Crispr/Cas9 in colture organotipiche di IPMN già stabilite presso i centri. PNRR-MCNT2-2023-12377462 Il progetto “Clinically approved drugs targeting pyruvate kinase M2: a drug repurposing pathway to move forward the treatment of glioblastoma” (PNRR-MCNT2-2023-12377462) (PI: Dott.ssa Susan Costantini) [Bando PNRR: M6/C2_CALL 2023 – Malattie croniche non trasmissibili (MCnT2) ad alto impatto sui sistemi sanitari e socioassistenziali: innovazione in campo terapeutico – Ministero della Salute] si propone di ricercare farmaci riposizionabili in grado di interferire con la proteina PKM2, eseguendo studi di virtual screening di composti/molecole presenti in librerie di farmaci, caratterizzazione della loro interazione con PKM2 e selezione fenotipica in modelli cellulari 2D e 3D di glioblastoma (GBM). Inoltre, al fine di valutare la modalità di azione dei farmaci selezionati, saranno effettuati studi di metabolomica mediante lo spettrometro di Risonanza Magnetica Nucleare analizzando il profilo endo- ed eso-metabolomico completo delle cellule GBM e non tumorali, prima e dopo i trattamenti farmacologici. 5XMILLE_2022_19 Il progetto “Studio del potenziale antitumorale dell’Acido Valproico come modulatore pleitropico del microambiente tumorale immunologico nel carcinoma del retto” [Bando 5×1000] (PI: Dott.ssa Maria Serena Roca) si propone di di esplorare il potenziale dell’acido valproico (VPA) come regolatore del microambiente tumorale-immunitario (TIME) nel carcinoma colorettale, una delle principali cause di mortalità oncologica. Nonostante i progressi nelle terapie mirate e immunoterapiche, la sopravvivenza dei pazienti con carcinoma colorettale metastatico rimane infatti limitata. Dati preliminari ottenuti nell’ambito di studi clinici condotti nel nostro Istituto hanno dimostrato che il VPA, un farmaco anticonvulsivante con proprietà antitumorali grazie alla sua attività di inibitore delle deacetilasi istoniche, è in grado di modulare il TIME, migliorando potenzialmente l’efficacia dei trattamenti combinati. Lo studio mira a utilizzare tecnologie avanzate di trascrittomica spaziale su tessuti chirurgici di pazienti trattati con VPA per analizzare i meccanismi molecolari alla base della sua azione ed identificare biomarcatori utili per nuove strategie terapeutiche. I risultati ottenuti saranno validati in una coorte più ampia di pazienti, con l’obiettivo di definire il ruolo del VPA nella modulazione del TIME e migliorare l’efficacia delle immunoterapie per il carcinoma colorettale. SPOKE 1_PROMINENT Il progetto “Personalised Rna-Oriented MedIcINE in Italy Novel Therapeutics – PROMINENT” (PI UO: Dott.ssa Elena Di Gennaro) [Bando a Cascata – Partenariato Esteso “Health Extended Alliance for Innovative Therapies, Advanced Lab-research, and Integrated Approaches of Precision Medicine” – HEAL ITALIA, (codice PE00000019) – CUP E83C22004670001 – PNRR – MISSIONE 4 COMPONENTE 2 “Dalla Ricerca all’Impresa” – Investimento 1.3, finanziato dall’Unione europea – NextGenerationUE –, a valere sull’Avviso pubblico del Ministero dell’Università e della Ricerca (MUR) n. 341 del 15.03.2022] si propone di individuare strumenti prognostici, diagnostici e terapeutici più efficaci, oltre a nuovi bersagli molecolari per le malattie croniche, tra cui il cancro, che rappresentano una delle maggiori sfide per la sanità in Italia. Questo obiettivo sarà raggiunto attraverso l’impiego di tecnologie omiche (genomica, trascrittomica, proteomica e metabolomica) e l’analisi dei big data. L’analisi del metaboloma mediante Risonanza Magnetica Nucleare (1H-NMR), la validazione in vitro dei metaboliti significativi identificati così come lo studio del ruolo dei miRNA identificati nella modulazione dei profili metabolici. Le analisi, condotte su plasma di donatori sani e pazienti affetti da diverse patologie tumorali quali i tumori del colon-retto, tumori della mammella e tumori del testa-collo saranno condotte dal gruppo di ricerca della SC di Farmacologia Sperimentale Oncologica. Progetto Ricerca Corrente 2025-2027: “Nuovi approcci terapeutici e medicina predittiva: Virtual screening, riposizionamento di farmaci e biomarcatori innovativi mediante tecnologie multiomiche” (PI: Dott.ssa Elena Di Gennaro) [LINEA 4/39_25] Questo progetto si propone di identificare nuovi biomarcatori prognostici e/o predittivi di risposta, e di progettare nuovi studi clinici di combinazione in pazienti affetti da diversi tumori solidi attraverso l’uso di analisi in silico, incluso il virtual screening, l’integrazione delle tecnologie di screening ad alta capacità e di diverse tecnologie omiche. Il progetto si articola in quattro task diverse: 1) identificazione di nuove molecole farmacologicamente attive e/o farmaci da repurposing con azione antitumorale; 2) valutazione dei potenziali effetti sinergici con terapie convenzionali in vitro ed in vivo; 3) studio del meccanismo molecolare alla base dell’azione farmacologica delle molecole identificate; 4) validazione di biomarcatori prognostici e/o predittivi di risposta nell’ambito degli studi clinici. Progetto Ricerca Corrente 2025-2027: “Valutazione di nuovi marcatori prognostici e bersagli terapeutici correlati alla proteina VCP/p97 in tumori solidi” (PI: Dott.ssa Susan Costantini) [LINEA 3/14_25] Questo progetto prevede: la valutazione dell’espressione di VCP/p97 e di altri fattori correlati a questa proteina, in TMA e campioni di plasma di pazienti con cancro mammario di tipo triplo-negativo (TNBC) ed anche la valutazione del profilo metabolomico, lipidomico e miRNA, negli stessi campioni di plasma (Task 1); la valutazione degli effetti di inibitori noti di VCP/p97 e proteine ad essa correlate in cancro mammario TNBC e cancro al pancreas (Task2); e l’identificazione di nuovi potenziali inibitori di VCP/p97 applicando un approccio di riposizionamento di farmaci basato su studi computazionali e sperimentali (Task3). Progetto Ricerca Corrente 2025-2027: “Studio degli effetti immunomodulatori della combinazione di acido valproico e simvastatina con il trattamento standard nel cancro pancreatico metastatico: un approccio di genere per una terapia personalizzata” (PI: Dott.ssa Federica Iannelli) [LINEA 2/69_25] Questo progetto mira a valutare l’efficacia della combinazione di acido valproico (VPA) e simvastatina (SIM), due farmaci generici e a basso costo, nel trattamento del carcinoma pancreatico metastatico (mPDAC). Si ipotizza che VPA e SIM agiscano sinergicamente modulando il microambiente tumorale (TME), riducendo la barriera fibrotica, migliorando l’efficacia della chemioterapia e stimolando la risposta immunitaria antitumorale. Studi preclinici hanno evidenziato gli effetti sinergici di questa combinazione, conducendo allo studio clinico VESPA (NCT05821556), che indaga il loro impatto sulla sopravvivenza libera da progressione (PFS) nei pazienti con mPDAC. L’analisi dei campioni di sangue dei pazienti arruolati nel braccio sperimentale dello studio VESPA, integrate con un’analisi approfondita delle caratteristiche immunologiche legate al genere e studi computazionali permetteranno di identificare biomarcatori predittivi e farmaci immuno-attivi efficaci con l’obiettivo di sviluppare terapie personalizzate che rispondano alle esigenze specifiche di ciascun paziente. Questo approccio rappresenta una potenziale rivoluzione nel trattamento di un tumore ad alta mortalità, aprendo nuove strade per la medicina di precisione. Progetto Ricerca Corrente 2025-2027: “Approccio epigenetico con acido valproico per potenziare l’efficacia della combinazione degli inibitori di BRAF ed EGFR nel carcinoma colorettale con mutazione BRAF V600E” (PI: Dott.ssa Roberta Affatato) [LINEA 4/72_25] Questo progetto ha l’obiettivo di valutare l’efficacia dell’acido valproico (VPA), un antiepilettico con comprovate proprietà antitumorali, in combinazione con la terapia a base di inibitori di BRAF/EGFR, al fine di migliorare l’effetto antitumorale e superare la resistenza acquisita a questi farmaci attraverso l’utilizzo di modelli preclinici in vitro e in vivo. Il progetto prevede inoltre di studiare le vulnerabilità terapeutiche e i meccanismi alla base dell’evoluzione della resistenza acquisita alla terapia anti-EGFR/BRAF. Pertanto, complessivamente il progetto mira ad identificare una nuova combinazione terapeutica che potrebbe essere integrata nella pratica clinica, ampliando così il continuum di cura per i pazienti affetti da mCRC con mutazione di BRAFV600E nelle fasi avanzate di trattamento. Progetto Ricerca Corrente 2025-2027: “L’associazione di acido valproico e simvastatina potenzia l’efficacia dell’anti-androgeno di seconda generazione, enzalutamide nel carcinoma prostatico metastatico resistente alla castrazione” (PI: Dott.ssa Laura Grumetti) [LINEA 4/74_25] La resistenza intrinseca agli antiandrogeni di seconda generazione, tra cui enzalutamide, interessa il 20–30 % dei pazienti con carcinoma prostatico metastatico resistente alla castrazione (mCRPC) ed è guidata da meccanismi sia AR-dipendenti che AR-indipendenti. Il progetto si pone l’obiettivo di valutare l’efficacia della combinazione di acido valproico – un inibitore delle HDAC noto per le sue proprietà antitumorali – e simvastatina, che blocca l’enzima HMG-CoA reduttasi nel pathway del mevalonato, nel superare la resistenza acquisita a enzalutamide nel mCRPC. Verranno approfonditi i meccanismi molecolari della resistenza, con particolare attenzione alla variante di splicing AR-V7, all’attivazione del recettore dei glucocorticoidi e ai marcatori di staminalità, sia in modelli in vitro che in vivo. Questa proposta fornirà nuove evidenze sui meccanismi di resistenza e proporrà una innovativa strategia terapeutica basata su due farmaci generici sicuri e già disponibili, facilmente traslabile nella pratica clinica. Progetto Ricerca Corrente 2025-2027: “Studio del ruolo dell’editing dell’RNA A-to-I nella tumorigenesi dell’adenocarcinoma duttale pancreatico: meccanismi, disregolazione e implicazioni terapeutiche” (PI: Dott.ssa Barbara Mandriani) [LINEA 4/62_25] Questo progetto esplora il ruolo dell’editing dell’RNA A-to-I nella progressione del tumore pancreatico. L’editing A-to-I, un processo post-trascrizionale che modifica in modo significativo le molecole di RNA convertendo le adenosine (A) in inosine (I), alterando RNA e proteine, contribuisce alla crescita e aggressività del carcinoma pancreatico (PDAC). Tale processo è mediato principalmente da una classe di enzimi chiamati deaminasi dell’adenosina (ADAR). Livelli elevati di ADAR1 sono significativamente elevati nei tessuti di PDAC e associati a segnali oncogenici cruciali. Il progetto si propone di comprendere i meccanismi molecolari attraverso cui gli enzimi ADAR influenzano l’espressione genica e sono responsabili di schemi anomali di editing dell’RNA, che vanno dalle piccole lesioni precancerose, come le neoplasie intraepiteliali pancreatiche (PanIN) e le neoplasie mucinose papillari intraduttali (IPMN), fino al carcinoma invasivo. A tale scopo saranno generati modelli cellulari di lesioni precancerose (PanIN, IPMN) e tumori, per mappare l’editing dell’RNA e studiare l’effetto della rimozione di ADAR. Si cercheranno anche inibitori di ADAR tramite screening computazionale e saggi in vitro, per valutarne l’efficacia come terapia innovativa per il PDAC. | The research activity of the Unity of Oncological Experimental Pharmacology is aimed at the development of new anti-tumor therapeutic approaches also using “drug repurposing” strategies based on preclinical and clinical studies, “in silico” and omics analyses. The research is divided into the following projects: REMEDI4ALL REMEDI4ALL project (BUILDING A SUSTAINABLE EUROPEAN INNOVATION PLATFORM TO ENHANCE THE REPURPOSING OF MEDICINES FOR ALL) (PI: Dott. Alfredo Budillon) [Call HORIZON-HLTH-2021-DISEASE-04 (EU)] has the aim of creating a European research and innovation platform, focused on patients’ needs, able to facilitate the access and rapid and economical development, to repositioned drugs. REMEDi4ALL is a multidisciplinary consortium led by EATRIS, involving twenty-four European organisations, four of which are Italian, with the common objective of repositioning drugs, already in clinical use, for other therapeutic indications. The project, which began on 1 September 2022, has a duration of 5 years in which the platform will provide services in all development phases necessary for the repositioning of the drug, from financing to preclinical development, from clinical trials to marketing. The VESPA trial The project “Randomized phase 2 study of valproic acid combined with Simvastatin and gemcitabine/nab-paclitaxel-based regimens in patients with untreated metastatic pancreatic adenocarcinoma (The VESPA trial)” (PI: Dott. Alfredo Budillon) [RF-2021-12371995 – Finalized Research Call 2021 (Ministry of Health )] aims to determine whether the addition of two repositioning drugs, valproic acid and simvastatin, to standard treatment with gemcitabine/nab-paclitaxel can improve the time until disease progression (progression-free survival) in patients with metastatic pancreatic cancer (PDAC) ). The VESPA clinical study will involve 240 patients from different centers in Italy and Spain. The VESPA study is a multicenter phase 2 study designed as a patient-centered study. Pharmacology targeting of CtBP1/BARS in cancer “Pharmacology targeting of CtBP1/BARS in cancer” project [GR-2018-12367517 – Finalized Research Call 2018 (Ministry of Health)] (PI: Dott.ssa Alessandra Leone) aims to identify small molecules capable of binding CtBP/BARS, an essential protein for the intracellular membrane trafficking, and for the Golgi complex breakdown in daughter cells before mitosis, but which also acts as a co-repressor of transcription. The aim of the project is to test the anti-tumor activity of these molecules, both as monotherapy and in association with conventional therapy, in prostate cancer models. Furthermore, the project also aims to evaluate the role of BARS in the secretion of protumor factors in prostate cancer and, in particular, in the regulation of Large Oncosomes (LO) secretion and their content. ACC_2022_PRECLINIC_MODELS “The ACC preclinical research platform for precision oncology” project [RCR-2022-23682287– Current Research IRCCS Networks 2022 Call (Ministry of Health)] involves the development of experimental models capable to recap correctly the tumor biology, genetic heterogeneity and response to precision oncology drugs. In the last years, ACC network has included in its research program several activities dedicated to the generation of patient-derived tumor models (PDCMs), their molecular profiling and pharmacological tests on these models. The present project aims to further expand this research line, to generate a preclinical platform that facilitates the activities of ACC members. Therefore, the objectives of the project are: to generate and make available online a catalog of PDCMs generated by various cancer types; develop innovative PDCMs, share standard protocols and procedures for PDCMs generation; generate and share DNA-seq and RNA-seq profiles of PDCMs, also profiling the tumor tissue and germline DNA when available; increase the capacity for pharmacological screening through a network of technological nodes and facilitate the preclinical validation of therapeutic hypotheses generated in the ACC network through molecular profiling performed on patient tumors. NARA “Multiparameter optimization and in vitro/in vivo Assessment of antagonists targeting androgen receptor’s ligand Binding Domain and Allosteric Binding Sites” project (Short title: In vitro/in vivo tests of New Androgen Receptor Antagonists – NARA) is part of the collaborative projects between Italy and South Africa – Great Relevance Projects (PGR) included in the Bilateral Scientific-Technological Executive Protocols – Ministry of Foreign Affairs and International Cooperation. It is the result of a collaboration with the group of Dr. Gumede Njabulo of the University of Mangosuthu University of Technology (MUT) – South Africa. The objective of the project is to develop new and effective androgen receptor antagonists to overcome resistance to castration and second generation anti-androgens in prostate cancer (PCa), based on the preclinical validation, in vitro and in vivo, of new androgen receptor antagonists derived from virtual screening. canSERV “Providing edge Cancer Research Services across Europe – canSERV” project [Call Horizon Europe–INFRA-2021-SERV-01 (Research infrastructure services to support healthcare research, accelerate green and digital transformation and advance frontier knowledge (2021) (EUROPEAN COMMISSION Horizon Europe (HORIZON)] is funded by the EU under the Horizon Europe program which provides cutting-edge, interdisciplinary and personalized oncology services. Its objective is to offer a comprehensive portfolio of cancer-related research services cancer available to all scientists in EU member countries, associated countries and beyond. Our laboratory is involved in the characterization and validation of results through in vitro tumor models (2D and 3D) and proteomics experiments. In collaboration with SSD di Sperimentazione Animale the characterization and validation of mouse models will be performed. TACTIC “Targeting drug resistant melanoma with miCroRNAs Delivered by Lipid NanoparTICles (TACTIC)” project (PI UO: Dott.ssa Susan Costantini) [PNRR Call: M6/C2_CALL 2022 – Proof of Concept (PoC) – Ministry of Health – PNRR-POC-2022-12375713] aims to carry out studies to determine the maximum tolerated dose of lipid nanoparticles carrying simultaneously three tumor suppressor miRs (miR-204-5p, miR-579-3p, and miR-199b-5p) (LNP-miR) to be used in efficacy studies; to demonstrate efficacy therapeutic of LNP-miR in “reversing” drug resistance in mouse models; and to establish PDX models derived from tumor lesions of drug-resistant patients in order to validate the obtained results. MITOFRAILTY “MITOCHONDRIAL GENETIC AND FUNCTIONAL ANALYSIS FOR A PERSONALIZED ASSESSMENT OF FRAILTY IN CRITICALLY ILL PATIENTS (MITOFRAILTY)” project (PI UO: Dott.ssa Elena Di Gennaro) [PNRR Call: M6/C2_CALL 2022 – Chronic Non-Communicable Diseases (MCnT) – Ministry of Health – PNRR-MAD-2022-12376767] aims to identify markers of frailty for an early selection of patients at high risk of prolonged hospitalization and adverse outcomes. Since the malfunctioning of mitochondria can be considered a biomarker of frailty and a potential target for prevention and therapy, oxidative stress, mitochondrial respiration and mtDNA copy number will be measured in blood cells of patients admitted to intensive care at the Sant’Andrea University Hospital in Rome in order to identify specific markers of frailty. PNRR-MCNT2-2023-12377998 The project “ValproIc aCid To pOtentiate anti-EGFR treatment efficacy and prevent/revert resistance In colorectal cAncer (VICTORIA)” (PNRR-MCNT2-2023-12377998) (PI: Dott. Alfredo Budillon) [PNRR Call: M6/C2_CALL 2023 – Chronic non-communicable diseases (MCnT2) with high impact on health and social care systems: innovation in the therapeutic field – Ministry of Health] aims to evaluate, in patients with metastatic colorectal tumors (mCRC) in absence of RAS and BRAF mutations, whether the addition of valproic acid (VPA), endowed with epigenetic properties, is able to improve the activity of anti-EGFR drugs, preventing and/or delaying the onset of resistance to anti-EGFR agents. Furthermore, translational studies on tissue and blood samples will help to identify potential biomarkers of efficacy and to understand the evolutionary dynamics of tumors in response to therapy, in order to understand the mechanisms of resistance and optimize the therapeutic approach with anti-EGFR monoclonal antibodies. PNRR-MCNT2-2023-12377229 The project “New theranostic biomarkers of Intraductal papillary mucinous neoplasm (IPMN) progression to pancreatic cancer for patient outcome improvement” (PNRR-MCNT2-2023-12377229) (PI UO: Dott.ssa Elena Di Gennaro) [PNRR Call: M6/C2_CALL 2023 – Chronic non-communicable diseases (MCnT2) with high impact on health and social care systems: innovation in the therapeutic field – Ministry of Health] aims to identify molecular markers capable of predicting the malignant transformation of intraductal papillary mucinous neoplasms (IPMN) to pancreatic ductal adenocarcinoma (PDAC) to select those patients who require immediate pancreatic surgery. In detail, an epithelial-specific characterization of IPMNs will be carried out from the point of view of both gene expression (single nuclei) and epigenome changes (ATAC-seq) in IPMN and pancreatic cancer samples. Secondly, the previously identified markers and their role as prognostic factors will be validated both on archival tissue samples and on plasma, through a retrospective analysis on a cohort of patients affected by IPMN. Furthermore, knowledge-based tools will be developed for the diagnosis and treatment of IPMN patients and the population at risk of pancreatic cancer. Validation analyzes will be performed to establish the specific role of the most relevant genes in IPMN carcinogenesis, through pharmacological inhibition (where possible) or a genetic approach using the Crispr/Cas9 genome editing methodology in organotypic IPMN cultures. PNRR-MCNT2-2023-12377462 The project “Clinically approved drugs targeting pyruvate kinase M2: a drug repurposing pathway to move forward the treatment of glioblastoma” (PNRR-MCNT2-2023-12377462) (PI: Dott.ssa Susan Costantini) [PNRR Call: M6/C2_CALL 2023 – Chronic non-communicable diseases (MCnT2) with high impact on health and social care systems: innovation in the therapeutic field – Ministry of Health – PNRR-MCNT2-2023-12377462 ] aims to research drugs repositionables capable of interfering with PKM2 protein, performing virtual screening studies of compounds/molecules present in drug libraries, characterization of their interaction with PKM2 and phenotypic selection in 2D and 3D cellular models of glioblastoma (GBM). Furthermore, in order to evaluate the mode of action of the selected drugs, metabolomics studies will be carried out using the Nuclear Magnetic Resonance spectrometer, analyzing the complete endo- and exo-metabolomic profile of GBM and non-tumor cells, before and after the pharmacological treatments. 5XMILLE_2022_19 The project “Study of the anti-tumor potential of Valproic Acid as a pleitropic modulator of the immunological tumor microenvironment in rectal cancer” [Call for tender 5×1000] (PI: Dott.ssa Maria Serena Roca) aims to explore the potential of valproic acid (VPA) as a regulator of the tumor-immune microenvironment (TIME) in colorectal cancer, one of the main causes of oncological mortality. Despite advances in targeted therapies and immunotherapy, survival of patients with metastatic colorectal cancer remains limited. VPA, an anticonvulsant drug with anticancer properties due to its histone deacetylase inhibitor activity, has been shown to modulate TIME in preliminary clinical studies, potentially improving the efficacy of combined treatments. The study aims to use advanced spatial transcriptomic technologies on surgical tissues from patients treated with VPA to analyze the molecular mechanisms underlying its action and identify useful biomarkers for new therapeutic strategies. The results obtained will be validated in a larger cohort of patients, with the aim of defining the role of VPA in modulating TIME and improving the efficacy of immunotherapies for colorectal cancer. SPOKE1_PROMINENT The project “Personalised Rna-Oriented MedIcINE in Italy Novel Therapeutics – PROMINENT” (PI UO: Dott.ssa Elena Di Gennaro) [Cascade Call – Extended Partnership “Health Extended Alliance for Innovative Therapies, Advanced Lab-research, and Integrated Approaches of Precision Medicine” – HEAL ITALIA, (code PE00000019) – CUP E83C22004670001 – PNRR – MISSION 4 COMPONENT 2 “From Research to Business” – Investment 1.3, financed by the European Union – NextGenerationUE –, pursuant to the Public Notice of the Ministry of University and Research (MUR) n. 341 of 15.03.2022] aims to identify more effective prognostic, diagnostic and therapeutic tools, as well as new molecular targets for chronic diseases, including cancer, which represent one of the major challenges for healthcare in Italy. This objective will be achieved through the use of omics technologies (genomics, transcriptomics, proteomics and metabolomics) and big data analysis. As part of the project, SC of Oncological Experimental Pharmacology is engaged in the recruitment of healthy donors and patients suffering from various tumor pathologies such as colorectal tumors, breast tumors and head and neck tumors). The following will be carried out: i) the analysis of the metabolome using Nuclear Magnetic Resonance (1H-NMR), ii) the in vitro validation of the significant metabolites identified and iii) the study of the role of the identified miRNAs in the modulation of metabolic profiles. Ricerca Corrente Project 2025-2027: “Novel therapeutical approaches and predictive medicine: Virtual Screening, Drug Repurposing and biomarkers innovation by multiomic technologies“ (PI: Dott.ssa Elena Di Gennaro) [LINEA 4/39_25] This project aims to identify new prognostic and/or predictive biomarkers of response, and to design new combination therapies to be tested in patients with different solid tumors, using in silico analyses, including virtual screening, integration of high-throughput screening technologies, and various omic technologies. The project is divided into four different tasks: 1) identification of new pharmacologically active molecules and/or repurposed drugs with antitumor activity; 2) evaluation of potential synergistic effects with conventional therapies in vitro and in vivo; 3) study of the molecular mechanism underlying the pharmacological action of the identified molecules; 4) validation of prognostic and/or predictive biomarkers of response within clinical studies. Ricerca Corrente Project 2025-2027: “Evaluation of new prognostic markers and therapeutic targets related to the VCP/p97 protein in solid tumors” (PI: Dott.ssa Susan Costantini) [LINEA 3/14_25] This project involves: the evaluation of the expression of VCP/p97 and other factors related to this protein, in TMA and plasma samples of patients with triple-negative breast cancer (TNBC) and also the evaluation of the metabolomic, lipidomic and miRNA profile, in the same plasma samples (Task 1); the evaluation of the effects of known inhibitors of VCP/p97 and related proteins in TNBC breast cancer and pancreatic cancer (Task2) ;and the identification of new potential VCP/p97 inhibitors by applying a drug repositioning approach based on computational and experimental studies (Task3). Ricerca Corrente Project 2025-2027: “Study of the immunomodulatory effects of the combination of valproic acid and simvastatin with standard treatment in metastatic pancreatic cancer: a gender approach for personalized therapy” (PI: Dott.ssa Federica Iannelli) [LINEA 2/69_25] This project aims to evaluate the efficacy of the combination of valproic acid (VPA) and simvastatin (SIM), two low-cost generic drugs, in the treatment of metastatic pancreatic ductal adenocarcinoma (mPDAC). We hypothesize that VPA and SIM act synergistically by modulating the tumor microenvironment (TME), reducing the fibrotic barrier, enhancing the effectiveness of chemotherapy, and stimulating an antitumor immune response. Preclinical studies have highlighted the synergistic effects of this combination, leading to the ongoing VESPA clinical trial (NCT05821556), which investigates their impact on progression-free survival (PFS) in mPDAC patients. The analysis of blood samples from participants in the experimental arm of the VESPA trial, integrated with an in-depth examination of gender-related immunological characteristics and computational studies, aims to identify predictive biomarkers and effective immuno-active drugs, with the goal of developing personalized therapies tailored to the specific needs of each patient. This approach has the potential to revolutionize the treatment of a high-mortality cancer, paving the way for new developments in precision medicine. Ricerca Corrente Project 2025-2027: “Epigenetic Approach with Valproic Acid to Enhance the Effectiveness of BRAF and EGFR Inhibitor Combination in Colorectal Cancer with BRAF V600E Mutation“ (PI: Dott.ssa Roberta Affatato) [LINEA 4/72_25] This project aims to evaluate the efficacy of valproic acid (VPA), an anticonvulsant with proven anticancer properties, in combination with BRAF/EGFR inhibitor therapy to enhance the antitumor effect and overcome acquired resistance to these drugs through the use of preclinical in vitro and in vivo models. Additionally, the project will investigate therapeutic vulnerabilities and the mechanisms underlying the evolution of acquired resistance to anti-EGFR/BRAF therapy. Therefore, the project aims to identify a new therapeutic combination that could be integrated into clinical practice, thereby expanding the continuum of care for patients with advanced-stage BRAF V600E mutated mCRC. Ricerca Corrente Project 2025-2027: “The association of valproic acid and simvastatin potentiate the efficacy of the second-generation anti-androgen, enzalutamide, in metastatic castration resistance prostate cancer” (PI: Dott.ssa Laura Grumetti) [LINEA 4/74_25] Intrinsic resistance to second-generation antiandrogens, including enzalutamide, affects 20–30% of patients with metastatic castration-resistant prostate cancer (mCRPC) and is driven by both AR-dependent and AR-independent mechanisms. This project aims to evaluate the efficacy of combining valproic acid—a well-known HDAC inhibitor with antitumor properties—and simvastatin, which inhibits HMG-CoA reductase in the mevalonate pathway, to overcome acquired enzalutamide resistance in mCRPC. We will investigate the molecular mechanisms of resistance, focusing in particular on the AR-V7 splice variant, glucocorticoid receptor activation, and stemness markers, using both in vitro and in vivo models. This proposal will provide new insights into resistance mechanisms and will propose an innovative therapeutic strategy based on two safe, generic drugs that are readily available and easily translatable into clinical practice. Ricerca Corrente Project 2025-2027: “Study of the Role of A-to-I RNA Editing in the Tumorigenesis of Pancreatic Ductal Adenocarcinoma: Mechanisms, Dysregulation, and Therapeutic Implications” (PI: Dott.ssa Barbara Mandriani) [LINEA 4/62_25] This project explores the role of A-to-I RNA editing in the progression of pancreatic cancer. A-to-I editing, a post-transcriptional process that significantly modifies RNA molecules by converting adenosines (A) into inosines (I), alters both RNA and proteins and contributes to the growth and aggressiveness of pancreatic ductal adenocarcinoma (PDAC). This process is primarily mediated by a class of enzymes known as adenosine deaminases acting on RNA (ADAR). Elevated levels of ADAR1 are significantly increased in PDAC tissues and are associated with key oncogenic signaling pathways. The project aims to elucidate the molecular mechanisms through which ADAR enzymes influence gene expression and drive abnormal RNA editing patterns, from early precancerous lesions—such as pancreatic intraepithelial neoplasia (PanIN) and intraductal papillary mucinous neoplasms (IPMN)—to invasive carcinoma. To this end, cellular models of precancerous lesions (PanIN, IPMN) and tumors will be developed to map RNA editing and investigate the effects of ADAR depletion. Additionally, ADAR inhibitors will be sought through computational screening and in vitro assays to assess their potential as an innovative therapeutic strategy for PDAC. |
BREVETTI/PATENTS
Budillon A, Bruzzese F, Iannelli F, Roca MS. COMBINATION OF VALPROIC ACID AND STATINS FOR USE IN THE TREATMENT OF PANCREATIC CANCER. Patient filed PCT/EP2023058 948.
PERSONALE/STAFF
Direttore FF/Acting Director
Dr.ssa Elena Di Gennaro (Dirigente Biologo) – 081 1777 0584 – e.digennaro@istitutotumori.na.it (ORCID: 0000-0001-6223-7845)
Dirigenti/Staff Scientists
Dr.ssa Susan Costantini (Dirigente Chimico) – 0825 1911729 – s.costantini@istitutotumori.na.it (ORCID: 0000-0002-7538-4657)
Dr.ssa Federica Iannelli – f.iannelli@istitutotumori.na.it (ORCID: 0000-0002-3301-0884)
Dr.ssa Alessandra Leone (Dirigente Biologo) – 081 17770585 – a.leone@istitutotumori.na.it (ORCID: 0000-0002-1051-2937)
Dr. Biagio Pucci (Dirigente Biologo) – 0825 1911722- b.pucci@istitutotumori.na.it (ORCID: 0000-0003-4502-1748)
Dr.ssa Maria Serena Roca – s.roca@istitutotumori.na.it (ORCID: 0000-0002-9621-0939)
Tecnici di Laboratorio/Laboratory Technician (Staff)
Dott.ssa Tania Moccia – t.moccia@istitutotumori.na.it (ORCID: 0000-0002-0463-9552)
Dr. Carlo Vitagliano – carlo.vitagliano@istitutotumori.na.it (ORCID: 0000-0003-0352-7580)
Dott.ssa Erica Stanco – erica.stanco@istitutotumori.na.it
Ricercatori Sanitari/Researchers (Piramide)
Dr.ssa Laura Addi – laura.addi@istitutotumori.na.it (ORCID: 0000-0002-0389-3559)
Dr.ssa Roberta Affatato – roberta.affatato@istitutotumori.na.it (ORCID: 0000-0002-2235-039X)
Dr.ssa Laura Grumetti – laura.grumetti@istitutotumori.na.it (ORCID: 0000-0002-9976-0282)
Dr.ssa Barbara Mandriani – barbara.mandriani@istitutotumori.na.it (ORCID: 0000-0002-4139-0602)
Ricercatori Sanitari (Contratto)/Researchers (Contract)
Dr.ssa Palmina Bagnara – palmina.bagnara@istitutotumori.na.it (ORCID: 0000-0003-1563-7381)
Dr.ssa Veronica Barile – veronica.barile@istitutotumori.na.it (ORCID: 0009-0008-7319-2724)
Dr.ssa Antonella Esposito – antonella.esposito@istitutotumori.na.it (ORCID: 0000-0002-1743-7984)
Dr.ssa Lucia La Sala – lucia.lasala@istitutotumori.na.it (ORCID: 0000-0003-1896-410X)
Dr.ssa Carmen Maccanico – carmen.maccanico@istitutotumori.na.it (ORCID: 0009-0008-5717-7516)
Dr.ssa Rossella Migliorino – rossella.migliorino@istitutotumori.na.it (ORCID: 0000-0003-0341-3495)
Dr.ssa Eugenia Passaro – eugenia.passaro@istitutotumori.na.it (ORCID: 0000-0002-8018-3737)
Dr.ssa Rita Rosa – rita.rosa@istitutotumori.na.it (ORCID: 0009-0002-3528-2434)
Tecnici di Laboratorio/Laboratory Technician (Piramide)
Dr.ssa Cristina Testa – cristina.testa@istitutotumori.na.it (ORCID: 0000-0003-3673-7250)
Tecnici di Laboratorio (Contratto)/Laboratory Technician (Contract)
Dr.ssa Eleonora Perfetto – eleonora.perfetto@istitutotumori.na.it (ORCID: 0009-0004-6579-1218)
Dr.ssa Federica Renza – federica.renza@istitutotumori.na.it (ORCID: 0009-0003-4665-4341)
Dr.ssa Maria Crispino – maria.crispino@istitutotumori.na.it
Borsisti/Fellows
Dr.ssa Chiara Argenziano – chiara.argenziano@istitutotumori.na.it (ORCID: 0009-0000-6652-928X)
Dr.ssa Carmela Dello Russo – carmela.dellorusso@istitutotumori.na.it (ORCID: 0009-0001-9981-4295)
Dr.ssa Sofia Piscitelli- sofia.piscitelli@istitutotumori.na.it (ORCID: 0009-0009-9207-7753) (Dottoranda)
Dr.ssa Federica Ciampi – federica.ciampi@istitutotumori.na.it (ORCID: 0009-0002-7377-8561)
PRINCIPALI PUBBLICAZIONI/MAIN PUBLICATIONS
1. Piro G, Roca MS, Bruzzese F, Carbone C, Iannelli F, Leone A, Volpe MG, Budillon A, Di Gennaro E. Vorinostat Potentiates 5-Fluorouracil/Cisplatin Combination by Inhibiting Chemotherapy-Induced EGFR Nuclear Translocation and Increasing Cisplatin Uptake. Mol Cancer Ther. 2019 Aug;18(8):1405-1417. doi: 10.1158/1535-7163.MCT-18-1117. Epub 2019 Jun 12. PMID: 31189612.
2. Ciardiello C, Leone A, Lanuti P, Roca MS, Moccia T, Minciacchi VR, Minopoli M, Gigantino V, De Cecio R, Rippa M, Petti L, Capone F, Vitagliano C, Milone MR, Pucci B, Lombardi R, Iannelli F, Di Gennaro E, Bruzzese F, Marchisio M, Carriero MV, Di Vizio D, Budillon A. Large oncosomes overexpressing integrin alpha-V promote prostate cancer adhesion and invasion via AKT activation. J Exp Clin Cancer Res. 2019 Jul 18;38(1):317. doi: 10.1186/s13046-019-1317-6. PMID: 31319863; PMCID: PMC6639931.
3. Ciardiello C, Migliorino R, Leone A, Budillon A. Large extracellular vesicles: Size matters in tumor progression. Cytokine Growth Factor Rev. 2020 Feb;51:69-74. doi: 10.1016/j.cytogfr.2019.12.007. Epub 2019 Dec 31. PMID: 31937439.
4. Iannelli F, Roca MS, Lombardi R, Ciardiello C, Grumetti L, De Rienzo S, Moccia T, Vitagliano C, Sorice A, Costantini S, Milone MR, Pucci B, Leone A, Di Gennaro E, Mancini R, Ciliberto G, Bruzzese F, Budillon A. Synergistic antitumor interaction of valproic acid and simvastatin sensitizes prostate cancer to docetaxel by targeting CSCs compartment via YAP inhibition. J Exp Clin Cancer Res. 2020 Oct 8;39(1):213. doi: 10.1186/s13046-020-01723-7. PMID: 33032653; PMCID: PMC7545949.
5. Lombardi R, Sonego M, Pucci B, Addi L, Iannelli F, Capone F, Alfano L, Roca MS, Milone MR, Moccia T, Costa A, Di Gennaro E, Bruzzese F, Baldassarre G, Budillon A. HSP90 identified by a proteomic approach as druggable target to reverse platinum resistance in ovarian cancer. Mol Oncol. 2021 Apr;15(4):1005-1023. doi: 10.1002/1878-0261.12883. Epub 2021 Jan 19. PMID: 33331136; PMCID: PMC8024727.
6. Avallone A, Piccirillo MC, Nasti G, Rosati G, Carlomagno C, Di Gennaro E, Romano C, Tatangelo F, Granata V, Cassata A, Silvestro L, De Stefano A, Aloj L, Vicario V, Nappi A, Leone A, Bilancia D, Arenare L, Petrillo A, Lastoria S, Gallo C, Botti G, Delrio P, Izzo F, Perrone F, Budillon A. Effect of Bevacizumab in Combination With Standard Oxaliplatin-Based Regimens in Patients With Metastatic Colorectal Cancer: A Randomized Clinical Trial. JAMA Netw Open. 2021 Jul 1;4(7):e2118475. doi: 10.1001/jamanetworkopen.2021.18475. PMID: 34309665; PMCID: PMC8314140.
7. Roca MS, Moccia T, Iannelli F, Testa C, Vitagliano C, Minopoli M, Camerlingo R, De Riso G, De Cecio R, Bruzzese F, Conte M, Altucci L, Di Gennaro E, Avallone A, Leone A, Budillon A. HDAC class I inhibitor domatinostat sensitizes pancreatic cancer to chemotherapy by targeting cancer stem cell compartment via FOXM1 modulation. J Exp Clin Cancer Res. 2022 Mar 3;41(1):83. doi: 10.1186/s13046-022-02295-4. Erratum in: J Exp Clin Cancer Res. 2022 Apr 11;41(1):138. PMID: 35241126; PMCID: PMC8892808.
8. Costantini S, Polo A, Capone F, Accardo M, Sorice A, Lombardi R, Bagnara P, Zito Marino F, Amato M, Orditura M, Fratelli M, Ciliberto G, Budillon A. An Integrated In Silico, In Vitro and Tumor Tissues Study Identified Selenoprotein S (SELENOS) and Valosin-Containing Protein (VCP/p97) as Novel Potential Associated Prognostic Biomarkers in Triple Negative Breast Cancer. Cancers (Basel). 2022 Jan 27;14(3):646. doi: 10.3390/cancers14030646. PMID: 35158912; PMCID: PMC8833666.
9. Costantini S, Di Gennaro E, Capone F, De Stefano A, Nasti G, Vitagliano C, Setola SV, Tatangelo F, Delrio P, Izzo F, Avallone A, Budillon A. Plasma metabolomics, lipidomics and cytokinomics profiling predict disease recurrence in metastatic colorectal cancer patients undergoing liver resection. Front Oncol. 2023 Jan 11;12:1110104. doi: 10.3389/fonc.2022.1110104. PMID: 36713567; PMCID: PMC9875807.
10. Cardone C, De Stefano A, Rosati G, Cassata A, Silvestro L, Borrelli M, Di Gennaro E, Romano C, Nappi A, Zanaletti N, Foschini F, Casaretti R, Tatangelo F, Lastoria S, Raddi M, Bilancia D, Granata V, Setola S, Petrillo A, Vitagliano C, Gargiulo P, Arenare L, Febbraro A, Martinelli E, Ciardiello F, Delrio P, Budillon A, Piccirillo MC, Avallone A. Regorafenib monotherapy as second-line treatment of patients with RAS-mutant advanced colorectal cancer (STREAM): an academic, multicenter, single-arm, two-stage, phase II study. ESMO Open. 2023 Feb;8(1):100748. doi: 10.1016/j.esmoop.2022.100748. Epub 2023 Jan 3. PMID: 36603521; PMCID: PMC10024144.
11. Zebene ED, Lombardi R, Pucci B, Medhin HT, Seife E, Di Gennaro E, Budillon A, Woldemichael GB. Proteomic Analysis of Biomarkers Predicting Treatment Response in Patients with Head and Neck Cancers. Int J Mol Sci. 2024 Nov 21;25(23):12513. doi: 10.3390/ijms252312513. PMID: 39684225; PMCID: PMC11641594.
12. Zebene ED, Pucci B, Lombardi R, Medhin HT, Seife E, Di Gennaro E, Budillon A, Woldemichael GB. Serum-Based Proteomic Approach to Identify Clinical Biomarkers of Radiation Exposure. Cancers (Basel). 2025 Mar 17;17(6):1010. doi: 10.3390/cancers17061010. PMID: 40149344; PMCID: PMC11940482.
13. Costantini S, Madonna G, Capone M, Di Gennaro E, Bagnara P, Renza F, Mallardo D, Affatato R, Vitagliano C, Romanelli M, Tuffanelli M, Simeone E, Ciliberto G, Ascierto PA, Budillon A. Metabolomic signatures in liquid biopsy are associated with overall survival in metastatic melanoma patients treated with immune checkpoint inhibitor therapy. J Exp Clin Cancer Res. 2025 Apr 10;44(1):119. doi: 10.1186/s13046-025-03378-8. PMID: 40211360; PMCID: PMC11983745.
14. Tanoli Z, Fernández-Torras A, Özcan UO, Kushnir A, Nader KM, Gadiya Y, Fiorenza L, Ianevski A, Vähä-Koskela M, Miihkinen M, Seemab U, Leinonen H, Seashore-Ludlow B, Tampere M, Kalman A, Ballante F, Benfenati E, Saunders G, Potdar S, Gómez García I, García-Serna R, Talarico C, Beccari AR, Schaal W, Polo A, Costantini S, Cabri E, Jacobs M, Saarela J, Budillon A, Spjuth O, Östling P, Xhaard H, Quintana J, Mestres J, Gribbon P, Ussi AE, Lo DC, de Kort M, Wennerberg K, Fratelli M, Carreras-Puigvert J, Aittokallio T. Computational drug repurposing: approaches, evaluation of in silico resources and case studies. Nat Rev Drug Discov. 2025 Mar 18. doi: 10.1038/s41573-025-01164-x. Epub ahead of print. PMID: 40102635.
15. Avallone A, Giuliani F, De Stefano A, Santabarbara G, Nasti G, Montesarchio V, Rosati G, Cassata A, Leo S, Romano C, Tamburini E, Silvestro L, Lotesoriere C, Nappi A, Santini D, Petrillo A, Colombo A, Febbraro A, Leone A, Mannavola F, Laterza MM, Izzo F, Sobrero A, Delrio P, Giannarelli D, Budillon A. Intermittent or Continuous Panitumumab Plus Fluorouracil, Leucovorin, and Irinotecan for First-Line Treatment of RAS and BRAF Wild-Type Metastatic Colorectal Cancer: The IMPROVE Trial. J Clin Oncol. 2025 Mar;43(7):829-839. doi: 10.1200/JCO.24.00979. Epub 2024 Nov 22. PMID: 39576946; PMCID: PMC11856000.
STUDI CLINICI/CLINICAL TRIALS
V-shortR3 (Phase ½ study of valproic acid and short-course radiotherapy plus capecitabine as preoperative treatment in low-moderate risk rectal cancer) [Delibera n. 33 del 11.01.2013]
BIOCORE (Evaluation of potential biomarkers in the peripheral blood of colorectal cancer patients) [Delibera n. 340 del 13.05.2014 – Protocol CEI: 7/14 oss]
COPRI (Phenotypic characterization and in vitro and in vivo chemosensitivity of primary cultures derived from solid tumors of different origins) [Delibera del 14.12.2016 –emendamento n. 84/23 del 20/02/2023 – Protocol CEI: 71/16]
IMPROVE (Intermittent or continuous treatment with Panitumumab + FOLFIRI in the first line in patients with RAS/BRAF wild-type metastatic colorectal cancer: a randomized phase 2 study) [Determina Dirigenziale n. 68 del 22.01.2018 – Protocol CEI: 65/17]
NICOLE (Preoperative nivolumab in patients with locally advanced colon cancer (T3 or T4): a window-of-opportunity study) [Determina Dirigenziale n. 122 del 31.01.2018 – Protocol CEI: 71/17]
BIOPRO (BIOmarker in PROstate Cancer) [Delibera del 28.10.2015 – emendamento n. 8/18 del 26/09/2018]
REVOLUTION (Randomized Phase II study on the association of Valproic Acid with FOLFOX/OXXEL and Bevacizumab in the treatment of metastatic colorectal cancer patients with RAS mutations) [Determina Dirigenziale n. 8 del 03.01.2019 – Protocol CEI: 34/18]
SELEBREC (The role of selenoproteins as possible prognostic markers in breast cancer) [Delibera n.1608 del 22.12.2021 – Protocol CEI: 57/21 oss]
EPOCA (Identification of novel prognostic/predictive markers of platinum resistance in ovarian cancer) [Delibera n. 1177 del 2.12.2022 – Protocol CEI: 39/22 oss]
BIO_HCC (Identification of circulating prognostic biomarkers in patients with advanced hepatocellular carcinoma (HCC).) [Protocol CEI: 3/23 oss]
VESPA (Valproic acid combinEd with Simvastatin and gemcitabine/nab-paclitaxel-based regimens in untreated metastatic Pancreatic Adenocarcinoma patients) [Delibera n. 1377 del 28/12/2022]
RIMEDIA (Translational research and application of Artificial Intelligence methods for the definition of “patient-centered” analgesic pathways in the pain treatment from pancreatic cancer) [Delibera n. 345 del 01.04.2022]
VICTORIA (Randomized phase 2 study of Valproic acid combined with rechallenge anti-EGFR based regimen regimens in pretreated patients with RAS/BRAF wild-type metastatic colorectal cancer) [Delibera n. 996 del 07.08.2024]
PROMINENT (NEW PERSONALIZED MEDICINE THERAPIES IN ITALY BASED ON RNA) [Protocol CEI: 58/24 OSS ]
PNRR-MCNT2-2023-1237722 (IDENTIFICATION OF NEW THERANOSTIC BIOMARKERS OF PANCREATIC TUMOR PROGRESSION OF INTRADUCTAL MUCINOUS NEOPLASIES (IPMN) IN ORDER TO IMPROVE THE PROGNOSIS AND CLINICAL MANAGEMENT OF PATIENTS) [Protocol CEI: 6/24]
IMPROVE-2 (Studio di fase 3 randomizzato della combinazione FOLFIRI + panitumumab in modalità intermittente o continuativa per il trattamento di prima linea di pazienti affetti da carcinoma del colon-retto non resecabile metastatico con sede sinistra e RAS/BRAF wild-type fase) [Protocol CEI: 3/24 RE]
STREAM-2 (Secondline Treatment with REgorafenib in Advanced RAS-Mutant colorectal cancer) [Prot. CEI: 23/25 RE]

